Trabalho
termodinâmico
Considere um gás contido em um cilindro provido de um êmbolo. Ao se expandir, o gás exerce uma força no êmbolo. O trabalho dessa força pode ser calculado.
Considere um gás contido em um cilindro provido de um êmbolo. Ao se expandir, o gás exerce uma força no êmbolo. O trabalho dessa força pode ser calculado.
t = P. ΔV
t = trabalho realizado pelo gás
P = pressão exercida pelo gás
ΔV = variação do volume
ΔV = Vfinal - Vinicial
Na expansão, Vfinal >
Vinicial è
temos t >0 (o gás realiza
trabalho).
Na compressão, Vfinal <
Vinicial è
temos t < 0 (o gás recebe
trabalho do meio exterior).
1ª lei da termodinâmica:
A
primeira lei da termodinâmica é o princípio da conservação de energia aplicado
a sistemas termodinâmicos. O princípio da conservação da energia baseia-se no
fato de que a energia não é criada e nem destruída, mas sim transformada.
Ao se fornecer
calor ao sistema, podemos observar a ocorrência de duas situações possíveis. Um
aumento de temperatura e uma expansão do gás. O aumento de temperatura
representa o aumento de energia interna do sistema e a expansão do gás
representa a realização de trabalho.
Pode-se concluir
que o calor fornecido ao sistema foi transformado na variação de energia
interna e na realização de trabalho. Desta conclusão, chega-se à primeira lei
da termodinâmica, que é definida da seguinte forma.
* Transformação ISOTERMICA: Numa transformação isotérmica, o calor trocado pelo gás com o exterior é
igual ao trabalho realizado no mesmo processo.
Como a
temperatura não varia, a variação da energia interna do gás é nula:
ΔU=0
e Q=t
ΔU: variação da energia interna.
Q: Quantidade de calor.
t: Trabalho.
* Transformação ISOBARICA: Pressão
constante.
Q= t+ ΔU
ΔU: variação da energia interna.
Q: Quantidade de calor.
t: Trabalho.
* Transformação
ISOCORICA: Numa transformação
Isocórica a variação da energia interna do gás é igual à quantidade de calor
trocada no meio exterior. Trabalho realizado é nulo, pois não há variação de
volume.
t=0 e Q= ΔU
ΔU: variação da energia interna.
Q: Quantidade de calor.
t: Trabalho.
* Transformação ADIABÁTICA: Um gás sofre uma transformação adiabática
quando não troca calor com o meio exterior. Essa transformação pode ocorrer
quando o gás esta contido no interior de um recipiente termicamente isolado do
ambiente ou sofre expansão e compressão suficientes rápidas para que as trocas
de calor com ambiente possam ser consideradas desprezíveis. Numa transformação
adiabática:
Q=0 e t= -ΔU
* Transformações CÍCLICAS: Consiste numa série de transformações gasosas na qual o
estado inicial coincide com o estado final, com o gás retornando à mesma pressão,
volume e temperatura iniciais.
Toda transformação cíclica deve obedecer às seguintes
condições:
•Se ele considerar o ciclo como um todo, as temperaturas
final e inicial são coincidentes (Ti=Tf), a variação de energia interna (ΔU) é
nula --- ΔU=0, sendo assim Q =
•Em toda transformação cíclica representada no diagrama
PxV, o trabalho realizado é fornecido pela área do ciclo.
•Se o ciclo é realizado no sentido horário, o trabalho é
positivo.
Revisão de Física 1
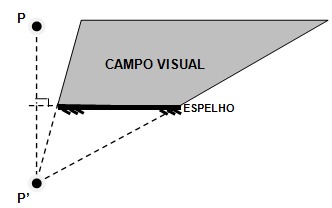
Para se fazer o campo de visão a partir de um ponto (observador) e um espelho plano
você deve:
1º Desenhar a imagem do ponto (mesma distância)
2º Traçar retas da imagem do ponto até as bordas do
espelho
Pronto agora você já tem o campo de visão
Deslocamentos de um espelho plano:
Se você tem um ponto fixo e um espelho plano, em certa
ocasião o espelho é movido a uma distância “d”, e a imagem andou “D”, esse D
será igual a 2.d
Em uma rotação não é
diferente, se temos um raio incidente e um raio refletido com um ângulo de 30º
em relação com a normal (60º no total), se giramos o espelho com um ângulo α, o
ângulo entre o RI e o RR aumentará 2α.
Associação de dois espelhos planos
Para calcular o número de IMAGENS que
a associação de dois espelhos planos vão produzir você usa a fórmula:
Onde α é o ângulo formado pelos dois
espelhos e n é o número de imagens.
Obs.: Se os espelhos planos forem
paralelos eles produziram infintas imagens.









Vai te resumo de Sociologia??
ResponderExcluir