Revolução Francesa:
* Antecedentes:
- Sociedade:
1º estado: Alto e baixo clero,
2º estado: nobres (Sangue e togada, comprada)
3º estado: plebe (burguesia incluída, tinham a maior
carga tributaria, queriam liberdade econômica e igualdade jurídica).
- Politica: Absolutismo (Luiz XVI + Mª Antonieta)
- Economia: SUPER crise, devido aos abalos climáticos,
grandes gastos da corte e guerra dos 7 anos.
- Devido à crise o rei foi obrigado a convocar a Assembleia
dos estados gerais: Deputados (cerca de 1000 no total) dos 3 estados discutiam
soluções para a crise. Tinham 2 propostas:
•+ impostos para a plebe
ou
•impostos iguais para todos
O 3° estado queria que os votos fossem por pessoa. Diante
da impossibilidade de conciliar os interesses, o Rei tenta impedir que o 3°
estado participe das reuniões, bloqueando sua entrada. Os representantes do 3°
estado se rebelam e resolvem criar a Assembleia Nacional Constituinte.
* Assembleia
Nacional Constituinte:
- Criam a guarda nacional, porem ainda sem armas.
- Invadem a bastilha (que era um dos grandes símbolos do
absolutismo) e pegam as armas.
- Prisão do rei, porem ele ainda continua com a “posição
de rei” em seu castelo.
- Elaboração de 3 documentos: Declaração dos direitos do
homem e do cidadão, constituição civil do clero e CONSTITUIÇÃO DE 1791 (adoção
dos 3 poderes, monarquia constitucional, fim dos privilégios da nobreza, voto sufrágio
censitário masculino, uso democrático da guilhotina).
- Tentativa de fuga do rei, a “galera” “fica de cara” e
instituem a Convenção.
* Convenção
(Republica):
- Inicia com os cargos nas mãos da alta burguesia.
- 3 Facções politicas: Girondinos (conservadores, alta
burguesia, direita), Montanheses (sans-culottes + jacobinos, radicais, baixa e
média burguesia, esquerda) e Planície (Meio termo, em cima do muro).
- Execução de Luiz XVI (Janeiro/1793)
- Republica jacobina: Após a morte do Rei, é instituída
uma nova constituição com um novo sistema eleitoral (sufrágio universal masculino).
- Ascenção de Robespierre.
- Robespierre faz ótimas reformas democráticas: Lei do
preço máximo, fim da supremacia da igreja católica, fim da escravidão nas
colônias e ensino gratuito.
- Mas por ser muito radical e pelo poder ter tomado a
cabeça de Robespierre (chegou a executar 2 mil em um dia), ele é executado
pelos Girondinos, e isso é a chamada reação termidoriana. Nela, os Girondinos
acabam com todas as reformas boas feitas pelo Robespierre. Eles instalam o
Diretório.
* Diretório
(Republica):
- 5 diretores, criam uma nova constituição elitista.
- Para a defesa do novo governo contratam Napoleão
Bonaparte.
- Conspiração dos iguais: Graco Babeuf
(san-cullote) organiza uma manifestação que condenava a propriedade privada e lutava por uma “ditadura
dos humildes”.
- Golpe 18 Brumário: Napoleão toma o poder (junto com
mais dois girondinos) e instala o consulado.
Massa molecular
– Veja todos os átomos que fazem parte da molécula, e calcule a massa, exemplo:
H=1 O=16
H2O -> 2.1 + 16 -> 18
Estequiometria Comum ou da Fórmula
Estes cálculos são relações de
grandezas. Utiliza-se regras de três simples.
Colocar sempre na primeira
linha os dados que já sabemos e na segunda linha os dados que devem ser
calculados.
Ex.:
Um mol de H2O tem 18 gramas,
qual o peso de 3mols?
1 mol –
18g
3 mol – x(g)
3 mol – x(g)
x = 54g de H2O
Reagente limitante e reagente em excesso
As vezes uma reação terá mais
que o necessário para formar o produto. Uma reação com apenas o necessário para
formar o produto:
2H + O -> H2O
Lembre-se! Existe uma proporção
para o número de mols em cada reação, nessa reação é:
2mol (de H) para 1mol (de O)
para 1mol (de H2O) .Uma outra reação apenas o necessário para formar o produto:
4H + 2O -> 2H2O
Uma reação que tem mais que o
necessário para formar o produto:
2H + 2O -> H2O
Você consegue ver que existe um
oxigênio que não é utilizado? Então chamamos o oxigênio, neste caso, de
Reagente em EXCESSO. E como toda a quantidade de hidrogênio é utilizada temos H
como reagente Limitante. Lembre-se que a proporção para a reação é sempre
seguida.
Exemplo:
Quantos mols de H2O serão formados ao final da reação:
8H +
2O -> xH2O
É
necessário descobrir a reação normal (2H + O -> H2O), descobrir a proporção
(2:1:1), logo em seguida descubra o reagente em Excesso e o reagente Limitante:
H em excesso e o O é o limitante. Então faça, seguindo a proporção, como se
existissem apenas 2O:
4H +
2O -> 2H2O
Essa
parte ficou meio confusa?
Cálculo de Pureza
Este cálculo é muito utilizado
nos laboratórios químicos, já que nenhuma substância é 100% pura. Sempre há
alguma impureza. Por este motivo, alguns problemas já indicam a quantidade de impureza
ou o quanto a substância é pura.
Se uma amostra de 40g de NaCl é
70% pura, quanto de NaCl há na amostra?
40g
– 100%
x (g) – 70%
x (g) – 70%
x = 28g de NaCl
Este é o primeiro passo para os
cálculos estequiométricos que envolvem reações químicas com cálculo de pureza.
Cálculo de Rendimento
Nenhuma reação química tem 100%
de aproveitamento. Geralmente a quantidade de produto pode ser inferior ao
valor esperado. Neste caso, o rendimento não foi total.
O cálculo de rendimento é feito
relacionando o valor esperado e o valor obtido de produto.
- Numa determinada reação
química:
2H + O -> H2O
Obteve-se apenas 50% de aproveitamento, quantas gramas de O serão necessárias para se produzir 180g de H2O?
Para se resolver esse exercício
você começa calculando o que acontece numa reação normal:
2.1g + 16g -> 18g
Porém a reação não foi total,
então você calcula a porcentagem de massa produzida pela reação
18g – 100%
X - 50%
Fazendo o calculo chegamos que x
= 9g, isto é: 2 gramas de hidrogênio, reagidos com 16gramas de oxigênio só vão
originar 9g de H2O. Mas o exercício quer saber quantas gramas de Oxigênio são
necessárias para produzir 180g de H2O, agora você só precisa usar uma regra de
três:
16g(de o) – 9g (de h2o)
Xg - 180g
X=320g logo serão necessárias 320g de oxigênio para
se produzir 180g de água.
Misturas
Quando misturarmos dois
elementos diferentes e não houver reação química teremos uma mistura.
Uma mistura pode ser
classificada como solução, quando a partícula dispersa for menor que 10^-7 cm.
Soluções
Soluto + Solvente
Coeficiente de solubilidade
(Cs) indica a quantidade máxima que se
pode dissolver um soluto em uma determinada quantidade de solvente, em certas
condições de temperatura e pressão, ex.:
Cs do NaCl -> 380g de NaCl para 1000g de água, a 15ºc
Tipos de soluções:
Solução Insaturada: Apresenta
menos soluto que o máximo permitido pelo Cs
Solução Saturada: Apresenta uma
quantidade de soluto igual ao máximo permitido
Solução Saturada com corpo de
fundo: Apresenta uma quantidade maior de soluto do que o permitido pelo Cs,
deixando soluto sem se dissolver.
Solução super-saturada: É
quando uma solução saturada com corpo de fundo, foi aquecida possibilitando o
dissolvimento do corpo de fundo e depois disso foi resfriado lentamente até a
temperatura inicial. (A solução vai estar com mais soluto que o permitido pelo
Cs. É uma solução instável, qualquer balanço pode fazê-lo voltar a ser saturado
com corpo de fundo)
Concentrações:
Concentração comum(C): é a
relação entre a massa do soluto(em gramas) com o volume da solução(em Litros) g/L
É calculado pela fórmula:
C = m1/v
Concentração comum = massa do
soluto/volume da solução
Ou por regra de três:
Em um recipiente temos 500ml de
água, adicionados 4g de NaCl, qual é a concentração molar?
Fórmula:
C = 4/0,5
C= 8g/L
Ou
Regra de três
4g – 0,5L
Xg – 1L
8g/L
Concentração molar (ou molaridade)(Mgay): é a relação entre a
quantidade de mols e o volume.
Fórmula: Mgay = n1/v sendo que
n1=m1/M
n1 - número de mols
m1 – massa do soluto
M – Massa molar
Ex.: Em 5L existem 15mols de NaOH,
qual a concentração molar?
15/5
3mol/L
Volume:
1mL = 1cm³
1dm³ = 1L = 1000mL
1mL = 1cm³
1dm³ = 1L = 1000mL
Massa:
1000Kg = 1ton
1Kg = 1000g
1g = 1000mg
1000Kg = 1ton
1Kg = 1000g
1g = 1000mg
Química 2
Compostos orgânicos são os que em sua composição apresentam o carbono como átomo principal. Ex.: C2H6O (Etanol)
O carbono é tetravalente, ou seja, faz obrigatoriamente quatro ligações covalentes. O carbono é capaz de formar cadeias.
Classificação dos carbonos em uma molécula:
Carbono primário – se liga um ou nenhum átomo de carbono
Carbono secundário – se liga a 2 átomos de carbono
Carbono terciário – se liga a 3 átomos de carbono
Carbono quaternário – se liga a 4 átomos de carbono
Classificação das cadeias carbônicas:
Aberta (ou acíclica ou alifática)
Fechadas (ou cíclicas)
Mistas
As cadeias carbônicas abertas podem ser:
•Normal (reta): Possui apenas carbonos primários e secundários
Ou
Ramificada: Possui carbonos terciários ou quaternários
•Homogênea: Não possui heteroátomo
Ou
Heterogênea: Possui heteroátomo.
*Heteroátomo -> um átomo diferente do carbono entre átomos de carbono, C – O – C
•Saturada: Só possui ligações simples entre carbonos (C – C – C = O)
Ou
Insaturada: Possui ligação dupla ou tripla entre carbonos (C = C – C – C)
Ex de classificação: Aberta, ramificada, heteroátomo e saturada.
As cadeias carbônicas fechadas podem ser:
• Alicíclica: Cadeia fechada sem anel aromático
- Homocíclica: Não possui heteroátomo
- Heterocíclica: Possui heteroátomo
• Aromática: Com anel aromático
- Mononuclear: Apenas um anel
- Polinuclear: Mais de um anel
• Saturada: Só possui ligações simples entre carbonos
Ou
Insaturada: Possui ligação dupla ou tripla entre carbonos
Ex de classificação: Fechada, alicíclica, homocíclica e saturada.
Ligações covalentes:
Simples: C – C (uma ligação sigma)
Dupla: C=C (uma ligação sigma e uma PI)
Tripla: C=C (Uma ligação sigma e duas PI)
Hibridação de carbonos:
|
–C – Hibridação Sp3
|
|
=C – Hibridação Sp2
=C= ou =C – Hibridação Sp
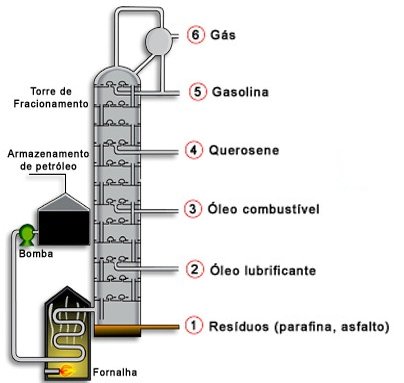
Petróleo: Composto por Hidrocarbonetos (C’s e H’s)
O petróleo é uma mistura de hidrocarbonetos, que para ser separada é necessário uma destilação fracionada.
Importante:
O conteúdo cobrado nos provões, será esse segundo a Ana Gabriela, e pelo que eu vejo estão de acordo com o que os nossos professores deram mais ênfase!
QUÍMICA
1-Classificação dos carbonos em primario, secundario, terciario e quaternário
2-Classificação das cadeias carbônicas (Saber diferenciar bem alifática, alicíclica e aromatica)
3-Determinação das hibridações do Carbono
4- Deterinação da formula molecular, inclusive que contenha o anel aromatico.
5-Petróleo (Teoria para o surgimento do petróleo, principais derivados da sua destilação e principais produtos oriundos dos derivados.
6-Estequiometria: massa(informada) / volume molar(pede)
7- Estequiometria: massa/massa involvendo rendimento e pureza
8-Calculo da concentração molar
HISTORIA
1-Destacar as causas da revolução francesa
2-Destacar as consequencias da revolução francesa
3- Definir 3o estado e suas reivindicações
4- Caracterizar a convenção nacional e o governo dos jacobinos
5-Definir Terror
6- Caracterizar a convenção termidoriana
7-Conspiração dos iguais


Jonathan, me passe seu email que recebi umas informações sobre a prova para voce postar aqui!
ResponderExcluirEnviei pro seu email, da uma olhada
ResponderExcluiresses coisas de química e historia são tipo cada questão? quem passou isso?
ResponderExcluiralguém tem o gabarito do CA de história??
ResponderExcluirvou me ferrar *-*
ResponderExcluirEu também D=
ResponderExcluirhistoria é materia bonus , quimica ta foda
ResponderExcluir